Absolute und relative Effekte am Beispiel der intensivierten Medikation nach akut dekompensierter Herzinsuffizienz
Aus dem Netzwerk evidenzbasierte Medizin
Von Nina Kreuzberger im Auftrag des Netzwerks Evidenzbasierte Medizin (www.ebm-netzwerk.de)
Die im November 2022 publizierte STRONG-HF-Studie untersuchte die optimale Medikationsstrategie bei Patientinnen und Patienten nach Krankenhausaufnahme aufgrund von akut dekompensierter Herzinsuffizienz (HI). Hierbei wurde in den ersten Wochen nach Krankenhausaufnahme die Dosierung folgender Medikamente gemäß Leitlinie maximiert: Betablocker, ACE-Hemmer (bzw. Angiotensin-Rezeptor-Blocker oder Angiotensin-Rezeptor-Neprilysin-Inhibitor), Aldosteron-Antagonist. Die Auftitration wurde anhand von Symptomatik, Blutdruck und Laborwerten gesteuert. Die Kontrollgruppe in dieser randomisiert kontrollierten Studie erhielt keine gezielte Therapiemaximierung.
Als Hauptergebnis konnte in der STRONG-HF-Studie für die intensivierte Medikation ein statistisch signifikant geringeres Risiko von HI-bedingter Rehospitalisierung oder Tod gezeigt werden. Umgekehrt erreichten dank der optimierten Medikation mehr Patientinnen und Patienten die NYHA-Klasse 1, also eine uneingeschränkte Belastbarkeit. Auch die Lebensqualität war in der Interventionsgruppe besser. Nicht unerwähnt bleiben darf aber auch, dass aufgrund der intensivierten Medikation mehr unerwünschte Ereignisse auftraten, z.B. Hypotension oder Hyperkaliämie. Insgesamt aber sprechen die Studienergebnisse dafür, sich um Patientinnen und Patienten nach HI-bedingter Hospitalisierung intensiv zu bemühen, um durch optimale hohe Medikamentendosierungen eine erneute Dekompensierung zu vermeiden.
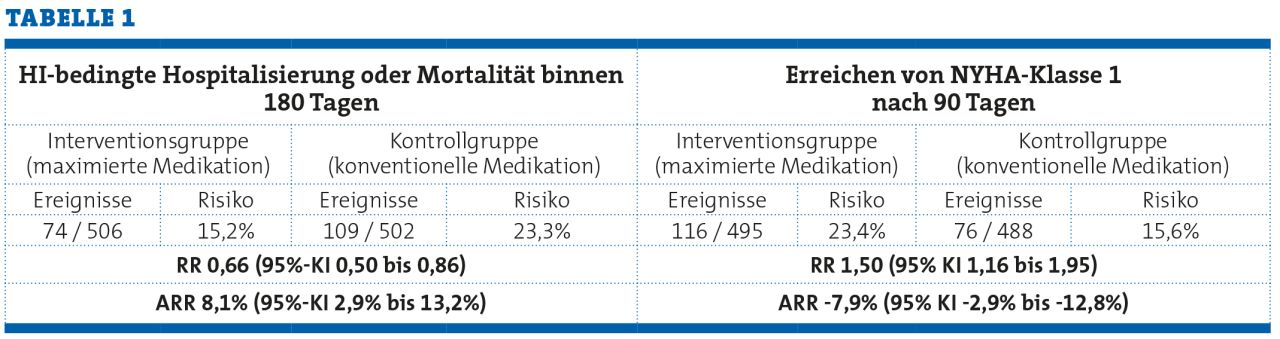
Dass die Zahlen in der Tabelle sich nicht alle exakt nachrechnen lassen, liegt an einer speziellen Analysemethode, was hier aber irrelevant ist und daher unbeachtet bleiben soll.
Relative und absolute Effekte – Richtung, Größe und Relevanz
Studienresultate werden bei binären Endpunkten, wie z.B. dem Gesamtüberleben oder der Krankenhausaufnahme, üblicherweise in Form von relativen Effektmaßen wie dem relativen Risiko (RR) oder dem Odds Ratio (OR) dargestellt. Diese relativen Effektmaße drücken das Ergebnis der Interventionsgruppe relativ zur Vergleichsgruppe aus, also z.B. die relative Häufigkeit des Versterbens in der Interventionsgruppe geteilt durch die relative Häufigkeit des Versterbens in der Kontrollgruppe. Bei einem Wert um die 1 herum ist der geschätzte Effekt in beiden Gruppen gleich. Bei Werten, die darunter oder darüber liegen und die gleichzeitig „signifikant“ sind, welches im Regelfall bei einem p-Wert kleiner 0,05 oder einem 95% Konfidenzintervall, das die 1 ausschließt, angenommen wird, gehen wir von einem Unterschied zwischen den Interventionen aus. Das RR (z.B. RR = 2) drückt das Verhältnis zwischen Interventions- und Kontrollrisiko aus, so ist ein Ereignis in der Interventionsgruppe RR-mal (zweimal) wahrscheinlicher als in der Kontrollgruppe.
Eine kurze Wiederholung der Interpretation des p-Wertes: Der p-Wert gibt die Wahrscheinlichkeit an, unter der Nullhypothese, also die Annahme, dass die Intervention keinen Effekt hat, einen größeren Effekt zu sehen als den, den wir berechnet haben. Je unwahrscheinlicher die Nullhypothese wird, desto eher sind wir bereit, eine alternative Hypothese zu akzeptieren. Traditionell, jedoch arbiträr beschlossen, liegt dieser Wert bei 0.05.
Fast selbstverständlich, jedoch trotzdem manchmal unbeachtet, sollte zuallererst die Richtung des Effektes aller erhobenen Endpunkte geprüft werden. Was drückt das vorliegende relative Risiko, das signifikant kleiner als 1 ist, eigentlich aus? Liegt es zugunsten der Intervention oder der Kontrollintervention? Ist das für alle Endpunkte dieser Studie so?
Die Richtung des Effektes hängt von der Definition des Ereignisses ab. Ein „schlechtes“ Ereignis kann in diesem Sinne Tod, Progression oder Krankenhausaufenthalt sein, wohingegen ein „gutes“ Ereignis z.B. die Symptomfreiheit zu einem bestimmten Zeitpunkt ist. Bei einem schlechten Ereignis hoffen wir, dass das Ereignis mit Behandlung seltener wird, bei guten Ereignissen hoffen wir, dass es häufiger wird. Die oben aus der STRONG-HF-Studie ausgewählten Ergebnisse illustrieren dies gut: Bei beiden Endpunkten zeigt sich ein Unterschied von etwa 15% zu 23% – jedoch in entgegengesetzter Richtung: Beim kombinierten Endpunkt Tod oder Rehospitalisierung bedeutet das RR von 0,66 einen Vorteil, weil hier weniger Ereignisse gewünscht sind. Beim Endpunkt NYHA-Klasse 1 zeigt das RR von 1,5 ebenfalls einen Vorteil der Interventionsgruppe an, weil hier mehr Ereignisse gut sind. Beide Effekte haben als RR die gleiche Größe, weil der Kehrwert von 1,5 gleich 0,66 ist.
Statistische Signifikanz und klinische Relevanz
Ist nun ein statistisch signifikanter Effekt mit einem Konfidenzintervall, dass die Schwelle zur Wirkungslosigkeit nicht schneidet, immer ein Grund, die geprüfte Therapie auch zu verwenden? Aus dem oben beschriebenem Studienergebnis (RR für Tod oder Rehospitalisierung = 0,66) kann konkludiert werden, dass das Risiko zu versterben oder rehospitalisiert zu werden mit intensivierter Medikation um circa 34%, also etwa ein Drittel, reduziert wird (relative Risikoreduktion, als Formel 100 x (RR-1) %). Ohne die Zahlen, die der Berechnung zugrunde liegen, scheint das Ergebnis sehr überzeugend für die Intervention zu sprechen. Es bleibt jedoch die Frage zu klären, ob der vorliegende Effekt klinisch relevant ist, also wichtig genug, um die Therapiemaximierung zu rechtfertigen, auch unter Berücksichtigung von Nebenwirkungen, Aufwand, nötiger Infrastruktur und Kosten.
Um dies beurteilen zu können, müssen relative Effektmaße in absolute Werte übersetzt werden. Ein häufig verwendetes absolutes Effektmaß ist die absolute Risikoreduktion (ARR), diese beschreibt den Unterschied zwischen den beiden beobachteten relativen Häufigkeiten. Der in der STRONG-HF-Studie beobachtete Unterschied von etwa 15% zu 23% im kombinierten Endpunkt Tod oder Rehospitalisierung bedeutet eine ARR von 23% - 15% = 8%. Vergleichen wir nun dies mit den Ergebnissen zu einem anderen Endpunkt, dem Versterben aufgrund kardiovaskulärer Ursache bis Tag 90.
Obwohl das relative Risiko und die relative Risikoreduktion in beiden Endpunkten sehr ähnlich sind, unterscheidet sich die absolute Risikoreduktion enorm: Beim kombinierten Endpunkt HI-bedingte Hospitalisierung oder Tod liegt die absolute Risikoreduktion mit 8% etwa um Faktor 4 größer als beim zweiten Endpunkt, dem (viel seltener auftretendem) kardiovaskulären Tod. Geläufiger und einfacher vorstellbar ist vielleicht noch die „Number Needed to Treat“ (NNT), auch wenn diese sich nur schwierig über Studien der gleichen Intervention hinweg zusammenfassen lässt: Beim ersten Endpunkt ist die NNT 1 / 0,081 = 12, für den zweiten Endpunkt beträgt die NNT1 / 0,022 = 45. Mit der intensivierten Medikation lässt sich demnach im Mittel bei jeder 12. Patientin HI-bedingte Hospitalisierung oder Tod verhindern, während aber nur bei jedem 45. Patienten ein kardiovaskulärer Todesfall vermieden wird. Hieran sieht man bereits, dass das Ausgangsrisiko für ein Ereignis, also das Risiko in der Kontrollgruppe bzw. unter normaler klinischer Behandlung, eine extrem wichtige Rolle für die Beurteilung der klinischen Relevanz darstellt. Da jedes Medikament Nebeneffekte hat, muss sehr genau abgewogen werden, ob man Hunderte von Patient:innen möglicherweise schweren Nebenwirkungen aussetzen möchte, um einen Todesfall zu verhindern.
„Framing“ von Effekten
Das Format, in dem Effekte präsentiert werden, z. B. in Studien oder in der Werbung, kann die Vor- und Nachteile einer Behandlung größer oder kleiner erscheinen lassen. Unser Informationsverständnis – so zeigen es viele Studien – reagiert auf relative und absolute Effekte unterschiedlich. Hat man in einem seltenen Endpunkt einen großen relativen Effekt, z. B. ein halbiertes Risiko, nachgewiesen, so neigen Menschen in Industrie und Wissenschaft dazu, eher das RR zu betonen anstatt mit der ARR deutlich zu machen, dass der Effekt vielleicht wenig klinische Relevanz besitzt. Ein anderer „Trick“ besteht darin, den Endpunkt „umzudrehen“, indem man das Gegenereignis betrachtet und hieraus das RR berechnet. So kann man anstelle einer Nebenwirkungsrate von 20% versus 10% mit einem RR von 2 auch die Rate nebenwirkungsfreier Verläufe betrachten, wo sich mit 80% versus 90% ein RR von knapp unter 1 berechnet.
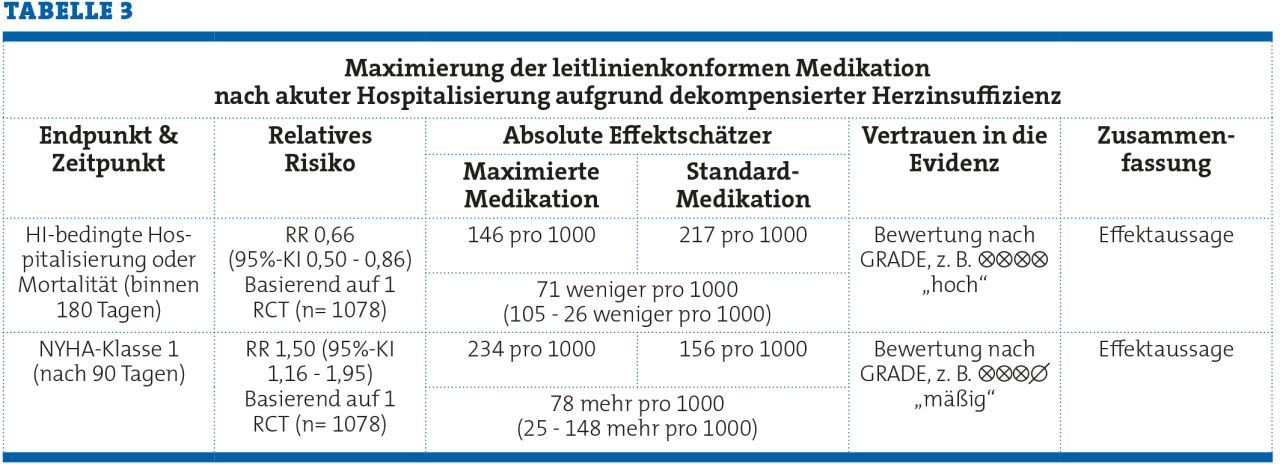
Um Effekte transparent und verständlich darzustellen, werden bei der Erstellung von Systematische Übersichtsarbeiten und klinischen Leitlinien immer häufiger absolute Werte gemeinsam mit den relativen Effektmaßen dargestellt (siehe z.B. die WHO-S3 COVID-19 Leitlinie unter https://www.bmj.com/content/370/bmj.m3379). Um die absoluten Zahlen sowohl zwischen den verschiedenen Endpunkten als auch zwischen verschiedenen Interventionen vergleichbar zu beschreiben, werden diese auf 1000 Patient:innen berechnet. Für das o.g. Beispiel würde sich die folgende Evidenztabelle ergeben (auch wenn man eigentlich die Ergebnisse zu HI-bedingten Hospitalisierungen und Mortalität in zwei separate Zeilen auftrennen würde) .
Zusammenfassend ist es also essentiell, dass evidenzbasierte Entscheidungen nicht nur auf relativen Effektmaßen oder gar nur auf p-Werten basieren, sondern dass die absoluten Risiken und Risikoreduktionen mit in Betracht gezogen werden.
NINA KREUZBERGER
Arbeitsgruppe für evidenzbasierte Medizin
Klinik I für Innere Medizin
Universitätsklinik Köln, Kerpener Str. 62, 50937 Köln
Kontakt: nina.kreuzberger@uk-koeln.de
Literatur:
Mebazaa A, Davison B, Chioncel O, Cohen-Solal A, Diaz R, Filippatos G, et al.: Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet 2022 (online ahead of print). doi: 10.1016/S0140-6736(22)02076-1